Лечение обширного дефекта вертлужной впадины у пациента с асептической нестабильностью тотального эндопротеза тазобедренного сустава
 |
 |
 |
| Н. В. Загородний | Г. А. Чрагян | О. А. Алексанян |
ФГБУ НМИЦ травматологии и ортопедии им. Н. Н. Приорова, Москва |
||
С момента внедрения в клиническую практику эндопротезирование зарекомендовало себя как основной метод лечения дегенеративно-дистрофических заболеваний и травматических повреждений тазобедренного сустава. Полученные положительные результаты привели к популяризации таких операций. На сегодняшний день тенденция к росту числа оперативных вмешательств тотального эндопротезирования тазобедренного сустава сохраняется как в России, так и во всем мире. Увеличение частоты первичного эндопротезирования, несмотря на совершенствование хирургической техники и повышение качества используемых имплантатов, сопровождается неуклонным ростом потребности в ревизионном эндопротезировании.
Цель данного исследования — на клиническом примере показать возможность лечения пациентов с тяжелыми дефектами таза путем проведения одноэтапного ревизионного эндопротезирования с использованием индивидуальной конструкции, изготовленной методом лазерного спекания на основе метода послойной 3D-визуализации.
Ежегодно, по данным экспертов Всемирной организации здравоохранения (ВОЗ), в мире выполняется 1 500 000 тотальных замещений тазобедренного сустава [1]. Прогнозируется, что в США спрос на тотальное эндопротезирование тазобедренного сустава (ТЭТБС) к 2030 году вырастет на 174% — до 572 000 процедур в год [2]. Увеличение частоты первичного эндопротезирования, несмотря на совершенствование хирургической техники и повышение качества используемых имплантатов, сопровождается неуклонным ростом потребности в ревизионном эндопротезировании тазобедренного сустава [3]. Причины этого могут быть разные: асептическое расшатывание, рецидивирующие вывихи головки эндопротеза, нестабильность компонентов эндопротеза, инфекция, остеолиз и др. [4]. Так, в США c 2005-го по 2030 год ожидается увеличение частоты ревизионного эндопротезирования тазобедренного сустава на 137% [2].
Такие факторы, как низкая доступность специализированной хирургической помощи в нашей стране, высокая стоимость ревизионных конструкций, неявка пациентов на контрольные осмотры, приводят к тому, что при ревизионном эндопротезировании хирург сталкивается с различными дефектами костной ткани [5, 6]. Если легкие дефекты с незначительной потерей костной ткани (типы IIА, IIВ, IIС по классификации Paprosky) обычно не представляют технической сложности, то лечение пациентов с обширными дефектами (IIIА, IIIВ, pelvicdiscontinuity) с отсутствием опо ры для вертлужного компонента эндопротеза является серьезной проблемой [7]. При таких дефектах реконструкция вертлужной впади ны с использованием стандартных компонентов не всегда приводит к благополучному исходу, и процент неудовлетворительных результа тов продолжает оставаться высо ким [3].
Материал и методы
Пациентка в возрасте 61 года по ступила в Национальный меди цинский исследовательский центр травматологии и ортопедии имени Н. Н. Приорова в 2017 году с жа лобами на боли и ограничение движения в области правого тазо бедренного сустава и нарушение походки. Из анамнеза стало из вестно, что она с детства страда ла врожденным вывихом головки правой бедренной кости. Получала консервативное лечение с времен ным положительным эффектом. В 1994 году на фоне консерватив ного лечения болевой синдром стал прогрессировать, по пово ду чего в ГКБ № 12 Москвы было выполнено первичное тотальное эндопротезирование правого тазо бедренного сустава эндопротезом Мовшовича – Гаврюшенко. Послеоперационный период протекал гладко, рана зажила первичным натяжением. В 2007 году появились легкие боли в области оперирванного сустава. В 2016 году псле падения на правый бок боли в оперированном суставе стали прогрессировать. В 2017 году па- циентка пришла на консультативный прием с жалобами на боли и ощущение нестабильности в правом тазобедренном суставе при незначительной физической нагрузке. Пациентку обследовали и после проведения рентгенографии таза выявили нестабильность тотального эндопротеза правого тазобедренного сустава: обширные сегментарные и полостные дефекты вокруг вертлужного компонента, миграция вертлужного компонента медиально и краниально, зона резорбции костной ткани вокруг цементной мантии бедренного компонента во всех зонах Груена. Рентгенологически дефект вертлужной впадины был оценен как тип IIIB по классификации Paprosky (рис. 1).
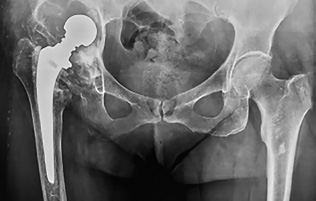
Рис. 1
Рентгенограмма таза пациентки при обращении в клинику. Дефект вертлужной впадины по классификации Paprosky тип IIIB
Учитывая выраженность костного дефекта вертлужной впадины, было принято решение об изготовлении индивидуального вертлужного компонента. В рамках данной госпитализации больной провели мультиспектральное КТ-сканирование таза с минимальной толщиной среза, с интервалом 0,5±0,1 мм для оценки потери костной массы. После обследования пациентка была выписана из стационара для повторной госпитализации при готовности имплантата.
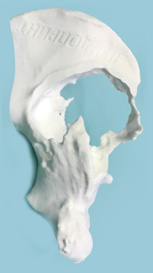
Полученный набор данных был записан на компакт-диск в формате DICOM и отправлен производителю (ООО «ИТК ЭНДОПРИНТ») для обработки изображения, очищения его от наводок, мягких тканей и создания цифровой 3D-модели пораженной стороны таза (рис. 2). Полученная цифровая 3D-модель в формате PDF была отправлена к нам для согласования. После чего на основании цифровой модели инженерами была создана пластиковая модель таза в натуральную величину со всеми дефектами вертлужной впадины с точностью до 1 мм (рис. 3).

Рис. 2
КТ-изображение пораженной стороны таза после обработки и очищения от наводок, мягких тканей
 |
 |
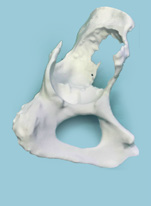 |
Рис. 3
Вид пластиковой модели таза с разных сторон. Визуализация дефектов вертлужной впадины с точностью до 1 мм
Следующий этап при моделировании имплантата — создание цифровой модели, которая должна была соответствовать следующим критериям (рис. 4):
- три фланца с отверстиями под винты для контакта с подвздошной, лонной и седалищной костями;
- оптимальная длина и направление винтов для максимальной фиксации в кости;
- пористое покрытие всех поверхностей имплантата, контактирующих с костью (рис. 3);
- большая полусферическая часть с возможностью использования пары трения большого диаметра или двойной мобильности;
- оптимальная пространственная ориентация полусферической части (отведение 40°, антеверсия 15°).

Рис. 4
Разработка цифровой модели имплантата: определение ориентации вертлужного компонента и направления винтов, моделирование фланцев
После получения окончательной цифровой модели была выполнена печать пробной пластиковой модели имплантата для сопоставления с пластиковой моделью таза. На данном этапе оценивается соответствие спроектированной модели имплантата костному дефекту. Полученная модель полностью соответствовала пластиковой модели таза, и дальнейшая корректировка не понадобилась. Была произведена окончательная печать трехфланцевого индивидуального вертлужного компонента на 3D-принтере из титанового порошка по технологии DMLS (см. рис. 5 и 6).
 |
 |
 |
Рис. 5 Вид окончательно распечатанной модели имплантата с разных сторон
 |
 |
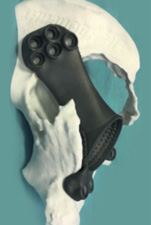 |
Рис. 6 Вид имплантата в пластиковой модели таза с разных сторон
Процесс создания имплантата с момента выполнения КТ до отправки готового изделия в клинику занял 14 рабочих дней. После получения готового имплантата пациентка была повторно госпитализирована. Стерилизация имплантата проводилась в клинике посредством автоклавирования. Операция выполнялась в положении больной лежа на здоровом боку с использованием прямого бокового доступа. Была произведена анатомическая установка индивидуальной 3D-конструкции согласно предоперационному планированию на пластиковой модели и фиксирована 9 винтами. В посадочное место 3D-имплантата установлен ацетабулярный компонент цементной фиксации Triloc II размером 48/32 мм. Для полного удаления цементной мантии из бедренного канала произведен трансфеморальный доступ. После проксимальный фрагмент фиксирован 4 серкляжными швами и в бедренную кость имплантирован ревизионный бедренный компонент Wagner SL (рис. 7).
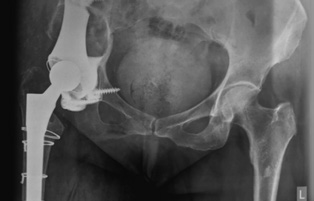 |
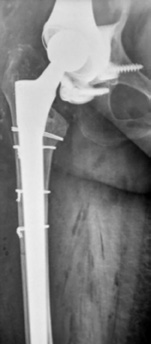 |
Рис. 7 Рентгенограммы после операции: достигнута прочная первичная фиксация имплантата в кости, восстановлено анатомическое положение вертлужной впадины
Результаты
Заживление послеоперационных ран первичным натяжением, септических осложнений области хирургических доступов не было. Длительность операции составила 220 мин, кровопотеря — 700 мл. Продолжительность нахождения пациентки в отделении реанима ции — 1 сутки. Общая продолжи тельность стационарного лечения — 11 дней. Септических осложнений, вывихов и миграции имплантатов в раннем послеоперационном периоде не было. До и после операционная оценка функции тазобедренного сустава проводилась по оценочным шкалам Harris Hip Score (HHS) и WOMAC.
Показатели HHS: до ревизионного эндопротезирования — 21 балл, через 1 мес. после операции — 44 балла, через 3 мес. после операции — 65 баллов, через 6 мес. — 82 балла. Качество жизни оценивали по шкале WOMAC: до операции — 73 балла, через 1 мес. после операции — 54 балла; через 3 мес. после операции — 31 балл, через 6 мес. после операции — 15 баллов. Пациентка передвигается без дополнительной опоры с полной нагрузкой на оперированную конечность. Единственная ее жалоба на момент последней консультации — затруднения самостоятельно стричь ногти на оперированной конечности.
Обсуждение и выводы
Основная цель сообщения — показать на клиническом примере сложность и актуальность ревизионного эндопротезирования при тяжелых дефектах вертлужной впадины. На сегодняшний день рынок ортопедических имплантатов предлагает широкий выбор конструкций различной сложности для ревизионного эндопротезирования вертлужной впадины. В зависимости от типа костного дефекта, количества и качества оставшейся кости, целостности стенок вертлужной впадины и непрерывности тазовой кости восстановление вертлужной впадины предполагает различные варианты. Исходя из типа костного дефекта ее восстановление может быть осуществлено с помощью различных методов, в том числе создания высокого центра ротации тазобедренного сустава [8], использования больших полусферических вертлужных компонентов [9], комбинированного применения аллотрансплантатов с антипротрузионными кольцами [10–16], использования опорных аугментов из трабекулярного металла в сочетании с полусферическими чашками [23], а также с применением техники cup-cage [17–22]. При выраженных костных дефектах (тип IIIА, IIIВ, IIIВ с на рушением целостности тазовой кости) реконструкция вертлужной впадины с использованием вышеописанных методик не всегда приводит к благополучному исходу и процент неудовлетворительных результатов продолжает оставаться высоким [3].
Имеющийся большой костный де фект вертлужной впадины поста вил нас перед проблемой выбора метода восстановления вертлужной впадины. Использование аллотрансплантатов в виде костных чипсов с антипротрузионным кольцом не позволило бы достичь первичной прочной фиксации конструкции и восстановления анатомического положения центра вращения вертлужной впадины. А использование нескольких опорных аугментов и полусферической чашки, склеенных между собой с помощью костного цемента, не обеспечивало бы достаточную жесткость конструкции, что при дальнейшей осевой нагрузке могло бы привести к пери протезному перелому и еще больше усугубить ситуацию. Кроме этого, данная методика с экономической точки зрения получалась гораздо дороже, чем затраты при создании индивидуального компонента.
Применение индивидуальных конструкций позволяет восстановить опороспособность нижней конечности и функцию тазобедренного сустава в случае обширного дефекта костей таза
Учитывая вышеупомянутые факторы, выбор был сделан в пользу индивидуальной конструкции с удлиненным верхним (подвздошным) фланцем, которая связывала между собой седалищную, подвздошную и лонные кости и добавляла прочность к оставшейся костной основе вертлужной впадины.Применение индивидуальных конструкций позволяет восстановить опороспособность нижней конечности и функцию тазобедренного сустава в случае обширного дефекта костей таза типа pelvic discontinuity.
