Использование индивидуальных вертлужных компонентов при первичном и ревизионном эндопротезировании тазобедренного сустава
 |
 |
 |
 |
| Н. В. Загородний | Г. А. Чрагян | О. А. Алексанян | С. В. Каграманов |
| ФГБУ НМИЦ травматологии и ортопедии им. Н. Н. Приорова, Москва | |||
С каждым годом наблюдается возрастающая тенденция тотального эндопротезирования тазобедренного сустава как в России, так и в мире в целом. Ежегодно, по данным экспертов группы ВОЗ, в мире выпол няется 1,5 млн тотальных замещений тазобедренного сустава [1].
Увеличение частоты первичного эндопротезирования, несмотря на совершенствование хирургической техники и повышение качества используемых им плантатов, сопровождается неуклонным ростом потребности в ревизионном эндопротезировании тазобедренного сустава. Причины этого могут быть разные: асептическое расшатывание, нестабильность сустава, инфекции, остеолиз и др. [2]. Так, в США c 2005-го по 2030 год ожидается увеличение частоты ревизионного эндопротезирования тазобедренного сустава на 137% [3].
Учитывая рост числа пациентов с тяжелыми разрушениями и дефектами вертлужной впадины, 3D-технология изготовления индивидуальных вертлужных компонентов является одним из методов решения проблемы лечения таких больных.
Обширная травма и длительная нестабильность эндопротеза приводят к тяжелому разрушению вертлужной впадины, что делает первичное и ревизионное эндопротезирование тазобедренного сустава сложной задачей, требующей больших реконструктивных вмешательств. Цель первичного и ревизионного эндопротезирования у больных с большими костными дефектами вертлужной впадины — достижение прочной фиксации и стабильности вертлужной конструкции, что в конечном счете обеспечивает остеоинтеграцию вертлужного компонента. Дефекты вертлужной впадины типа IIIB по Paprosky или расхождения тазовой кости (discontinuity) у пациентов, подвергшихся ревизионному эндопротезированию, встречаются в 1–5% случаев [4–7].
В зависимости от типа дефекта, количества и качества оставшейся костной ткани, способности к врастанию, целостности вертлужных колонн и непрерывности тазовой кости восстановление вертлужной впадины осуществляют с помощью различных методов, в том числе путем создания высокого центра ротации тазобедренного сустава [8], с использованием больших полусферических вертлужных компонентов (jumbo-cup) [9] или элементов костной пластики с комбинированным применением антипротрузионных колец или cup-cage [10–19], опорных аугментов из трабекулярного металла в сочетании с полусферическими чашками [20]. При выраженных костных дефектах (тип IIIА, IIIВ, IIIВ с нарушением целостности тазовой кости) реконструкция вертлужной впадины с использованием вышеописанных методик не всегда приводит к благополучному исходу, и процент неудовлетворительных результатов продолжает оставаться высоким.
В последнее время в отечественной и зарубежной литературе все чаще упоминается альтернативный метод лечения тяжелых костных дефектов вертлужной впадины с использованием технологии 3D-моделирования и прототипирования. H. Li и соавт. [21] представили хорошие результаты применения таких компонентов у 26 пациентов с массивным дефектом вертлужной впадины, прооперированных в период с 2003-го по 2013 год. С.С. Berasi и соавт. [22] в 2003–2012 годах выполнили 28 операций с применением индивидуальных вертлужных компонентов у 26 пациентов. С. Hogan и соавт. в 2 случаях использовали индивидуальные компоненты, однако в связи с массивным разрушением подвздошной кости проксимальный фланец фиксировали к крестцу [23].
В литературе представлено еще несколько обзоров серий пациентов с применением индивидуально изготовленных конструкций для лечения тяжелых дефектов вертлужной впадины [24–29].
Материал и методы
С октября 2017 года по ноябрь 2018 года нами выполнены 52 операции с применением изготовленных на 3D-принтере имплантатов вертлужной впадины у 52 пациентов. У 30 из них были выполнены ревизионные вмешательства по поводу асептического расшатывания, у 22 — первичное эндопротезирование по поводу посттравматического коксартроза. Среди прооперированных 23 женщины и 29 мужчин, их средний возраст составил 57,9±15,3 лет (от 31 до 80 лет). Всем пациентам на этапе предоперационного планирования и после операции в обязательном порядке выполняли рентгенограммы таза в передне-задней проекции. Выраженность потери костной ткани вертлужной впадины оценивали на передне-задних рентгенограммах тазобедренного сустава в соответствии с классификацией W. G. Paprosky [31].
В случае ревизионного эндопротезирования у 23 пациентов имели место дефекты типа IIIB с верхнемедиальной миграцией вертлужного компонента, в том числе у 5 — с расхождением тазовой кости, разрушением передней и задней колонн вертлужной впадины, а также медиальной стенки. В 5 случаях дефекты соответствовали типу IIIА с верхненаружной миграцией вертлужного компонента, а в 2 случаях — типу IIС. В случае первичного эндопротезирования у 5 пациентов были дефекты типа IIА, у 6 пациентов — IIB, у 2-х — типа IIC, у 6-ти — типа IIIA, у 3-х — типа IIIB (из них 2 с расхождением тазовой кости). Все пациенты с тяжелыми дефектами вертлужной впадины получали полную информацию о необходимости использования индивидуального вертлужного компонента. Все операции с применением индивидуальных вертлужных конструкций выполнены нами в соответствии с показаниями, сформулированными C. C. Berasi и соавт. [11]. Противопоказаниями к оперативному вмешательству были тяжелые сопутствующие заболевания в стадии декомпенсации и активный инфекционно-воспалительный процесс. Для создания индивидуальной конструкции вертлужной впадины нами был использован алгоритм, предложенный компанией «ИТК Эндопринт», которая специализируется на проектировании изображений и 3D-печати индивидуальных изделий в медицине. Алгоритм включал в себя следующие этапы:
- мультиспектральное КТ-сканирование таза с минимальной толщиной среза, с интервалом 0,5±0,1 мм для оценки потери костной массы;
- передача данных КТ в формате DICOM биоинженеру компании;
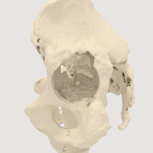
- обработка изображения, очищение его от наводок, мягких тканей и создание цифровой 3D-модели пораженной стороны таза (рис. 1);
- согласование цифровой 3D-модели в формате pdf с хирургом;
- создание пластиковой модели таза в натуральную величину на основании цифровой модели со всеми дефектами вертлужной впадины с точностью до 1 мм. На основании цифровой и реальной модели можно очень точно оценить степень дефицита костной ткани вертлужной впадины, верифицировать и классифицировать дефекты;
- создание цифровой модели имплантата в соответствии со следующими критериями:
- три фланца с отверстиями под винты для контакта с подвздошной, лонной и седалищной костями;
- оптимальная длина и направление винтов для максимальной фиксации в кости;
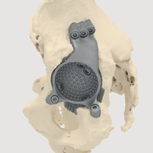
- пористое покрытие всех поверхностей имплантата, контактирующих с костью (рис. 2);
- оптимальная пространственная ориентация полусферической части (отведение 40°, антеверсия 15°);
- изготовление индивидуального вертлужного компонента на 3D-принтере из титанового порошка по технологии SLM;
- стерилизация компонента в клинике посредством автоклавирования.
|
|
 B |
 C |
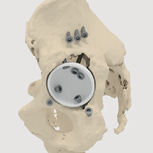
Рис. 1 Разработка цифровой модели имплантата:
А — цифровая модель таза;
В — определение ориентации компонента и направления винтов;
С — моделирование участков пористости, фланцев
В случае диссоциации тазовой кости компонент формировали таким образом, чтобы в процессе установки он создавал дистракцию таза, что обеспечит первичную стабильность имплантата.

Рис. 2 Пористая структура имплантата
Процесс создания имплантата занимает в среднем от 1,5 до 3 недель с момента выполнения КТ и осуществляется в тесном сотрудничестве с биоинженерами.
Техника операции. Все операции выполняли с использованием прямого бокового доступа. В случаях нестабильности после вскрытия капсулы сустава удаляли массивные рубцовые ткани, визуализировали компоненты эндопротеза. После мобилизации проксимальную часть бедренной кости выводили в рану, головку сбивали, проводили тесты на стабильность бедренного компонента. В случаях нестабильности его удаляли. Затем осуществляли доступ к вертлужному компоненту. После визуализации чашку удаляли. Со дна и стенок вертлужной впадины удаляли рубцовые ткани и выполняли минимальную обработку костных поверхностей, контактирующих с пористой поверхностью имплантата. В обязательном порядке осуществляли забор выделившейся жидкости и мягких тканей для микробиологического анализа. После тщательной промывки раневой полости растворами антисептиков имплантировали индивидуальную конструкцию.
Затем проводили фиксацию спонгиозными винтами через отверстия в чашке и фланцах для достижения первичной стабильной фиксации. Оптимальную длину и направление винтов подбирали индивидуально на этапе моделирования имплантата. У пациентов со стабильным бедренным компонентом на этапе проведения винтов в седалищную кость возникали технические трудности из-за плохой видимости данной области, возникшей после отведения проксимальной части бедра кзади. Решением в таких случаях являлось подтягивание проксимальной части бедренной кости кзади и латерально с помощью однозубого крючка, что обеспечивало достаточный обзор для проведения винтов. Также обязательным условием было тщательное удаление мягких тканей области седалищной и лобковой костей для устранения интерпозиции и сокращения времени установки имплантата. После установки и фиксации индивидуальной конструкции проводили позиционирование и фиксацию цементной полиэтиленовой чашки (см. рис. 3).
 A |
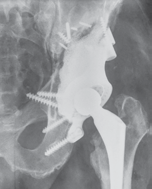 B |
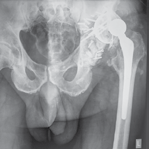
Рис. 3
А — рентгенограмма до операции: нестабильность вертлужного компонента тотального эндопротеза левого тазобедренного сустава, дефект вертлужной впадины по классификации Paprosky типа IIIB;
В — рентгенограмма после операции
В случаях первичного эндопротезирования после вскрытия капсулы сустава и вывихивания головки бедренной кости проксимальную часть бедренной кости выводили в рану, головку резецировали. Затем осуществляли доступ к вертлужной впадине. После удаления рубцовых тканей и определения истинных контуров вертлужной впадины выполняли обработку и установку индивидуального компонента по вышеизложенной методике. Затем обрабатывали бедренный канал фигурными рашпилями и фиксировали соответствующую ножку (см. рис. 4).
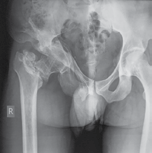 A |
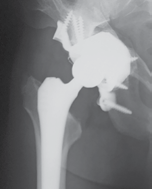 B |
Рис. 4
А — рентгенограмма до операции: правосторонний посттравматический коксартроз, дефект вертлужной впадины по классификации Paprosky типа IIС;
В — рентгенограмма после операции
После вправления бедренного компонента в вертлужный и тщательного промывания рану ушивали. Пациентов переводили в отделение реанимации.
РЕЗУЛЬТАТЫ
Интраоперационно на этапе освоения методики возникали трудности при установке конструкции во впадину, связанные, во-первых, с большими размерами имплантата, во-вторых, с его пористой частью, которая, цепляясь за мягкие ткани, приводила к их интерпозиции, тем самым препятствовала установке. Решением данной проблемы в последующем послужило упрощение конструкции за счет уменьшения размеров и пористой части имплантата при сохранении максимальной площади контакта с костной тканью. Поверхность имплантата, которая не контактировала с костной тканью, печатали гладкой для упрощения установки и уменьшения раздражения окружающих мягких тканей.
Необходимым условием оптимальной адаптации конструкции во впадине являлось удаление всех мягких тканей с области седалищной и лонной костей. Открывавшиеся кости служили точными ориентирами при адаптации фланцев. Кроме того, очень важный момент — правильный выбор плоскости установки имплантата, которая определяется на этапе разработки конструкции с учетом оперативного доступа, так как при заднем и передне-боковом доступах плоскости входа будут разными.
В 49 (94,3%) случаях констатировали точное совпадение имплантата с дефектом, что обеспечило прочную первичную фиксацию. В 3 (5,7%) наблюдениях (у пациентов с нарушением целостности тазовой кости) при установке исходно не удалось достичь стабильности имплантата, после коррекции костных структур и более детальной подгонки имплантат прочно фиксировали винтами.
Срок наблюдения составил от 2 до 14 месяцев.
В 2 случаях после операции развился парез малоберцовой порции седалищного нерва. Эти пациенты во время нахождения в стационаре получали соответствующее лечение, прописанное неврологом. На контрольном осмотре через 3 месяца у одного пациента наблюдалось полное восстановление функции, у второго — положительная динамика. У одного пациента с посттравматическим коксартрозом в результате падения через 1,5 месяца после операции произошел вывих головки эндопротеза. По месту жительства выполнено закрытое вправление. Через 3 месяца после операции у пациента развилась ОНМК. Лечился по месту жительства. После проведенного лечения и стабилизации состояния у пациента произошел повторный вывих головки эндопротеза. Выполнено закрытое вправление по месту жительства. Через 7 месяцев он обратился в 5-е отделение ЦИТО с жалобами на боли, ограничение движений, отечность и покраснение в области послеоперационного рубца. Диагностирована глубокая перипротезная инфекция. Принято решение об удалении эндопротеза и создании опорного неоартроза. У одной пациентки с нестабильностью вертлужного компонента и нарушением целостности тазовой кости при обращении через 3 месяца после операции на рентгенограммах определялась миграция седалищной кости относительно имплантата, однако рентгенологически имплантат оставался стабилен. Таким образом, в 96,1% случаев на рентгенограммах конструкции были стабильными.
ОБСУЖДЕНИЕ
На сегодняшний день в зарубежных и отечественных источниках медицинской литературы все чаще говорится о применении индивидуальных вертлужных конструкций при ревизионном эндопротезировании тазобедренного сустава у пациентов с тяжелыми дефектами области вертлужной впадины. Первые свидетельства успешного использования данных конструкций указывают на перспективность рассматриваемой технологии.
В 2012 году M. J. Taunton и соавт. [32] опубликовали результаты применения индивидуальных вертлужных конструкций у 57 пациентов со средним сроком наблюдения 65 месяцев. В этой группе 20 (30,3%) пациентам потребовались ревизионные вмешательства, причинами которых в основном являлись повторное расшатывание бедренного компонента эндопротеза, миграция вкладыша и инфекция. Асептическое расшатывание индивидуальной вертлужной конструкции наблюдалось в 5,3% случаев. Выживаемость конструкций составила 98%. У прооперированных с нарушением целостности тазовой кости в 81% случаев определялись рентгенологические признаки сращения. По мнению авторов, факт миграции большого вертела вследствие перипротезного перелома на фоне травмы или остеолиза может служить фактором риска развития нестабильности в послеоперационном периоде и, как следствие, привести к рецидивирующему вывиху головки эндопротеза. В таких случаях требуется дополнительная стабилизация пораженного тазобедренного сустава посредством пластики абдукторов или использования имплантатов с повышенной связанностью, таких как constrained-системы или компоненты двойной/тройной мобильности.
D. K. DeBoer и соавт. [33] также представили результаты ревизионных операций на 67 тазобедренных суставах по поводу асептического расшатывания с использованием индивидуальных конструкций при дефектах типа IV по классификации AAOS. Показатель выживаемости индивидуальных конструкций при среднем сроке наблюдения 53 месяца составил 100%. По мнению исследователей, значительная потеря костной основы снижает возможность надежной фиксации, а использование типовых модульных конструкций с опорой на аугменты может оказаться неэффективным наряду с высокой стоимостью, сравнимой с таковой при изготовлении индивидуальных имплантатов.
Включение в нашу группу пациентов с дефектами, которые не требуют обязательного использования индивидуальных конструкций, обусловлено этапом накопления опыта и отработки методики изготовления и установки имплантатов, произведенных с помощью 3D-проектирования. Хорошие ранние клинические и рентгенологические результаты получены практически во всех наблюдениях. При этом следует отметить, что рецидивирующие вывихи у описанного выше пациента, по нашему мнению, обусловлены не погрешностью в установке имплантата, а особенностями психосоциального статуса пациента и осложнениями после ОНМК. Тесное сотрудничество с инженерами компании «ИТК Эндопринт» на всех этапах создания индивидуальных конструкций позволило максимально точно предварительно оценить качество костной ткани, определить положение имплантата, длину и направление винтов.
Цементная фиксация полиэтиленовой чашки в отличие от аналогичных конструкций, где для фиксации вкладыша используется защелкивающийся механизм [34], дает возможность дополнительно корректировать наклон и антеторсию вертлужного компонента.
Вся поверхность задней части имплантата, контактирующая с костью пациента, имеет пористую микроструктуру. Таким образом, восстановление вертлужной впадины с выраженными костными дефектами с использованием индивидуальных вертлужных конструкций из титанового сплава с пористой контактирующей поверхностью обеспечивает максимальную поверхность контакта имплантата с костью и, следовательно, большую возможность врастания кости, что потенциально обеспечит долговременную стабильность.
Мы считаем, что данная технология будет наиболее эффективной при лечении тяжелых костных дефектов вертлужной впадины, принестабильности эндопротеза, посттравматического и, возможно, в некоторых случаях диспластического коксартроза. Первые результаты свидетельствуют о том, что использование индивидуальных вертлужных компонентов позволяет сократить время реконструкции тяжелых дефектов вертлужной впадины, поскольку нет необходимости примерять и подбирать аугменты для замещения таких дефектов.
ЗАКЛЮЧЕНИЕ
Современное программное обеспечение и 3D-принтеры позволяют сделать доступнее производство индивидуальных вертлужных компонентов. Учитывая увеличивающееся количество пациентов тяжелыми разрушениями и дефектами вертлужной впадины, 3D-технология изготовления индивидуальных вертлужных компонентов является одним из метод решения проблемы лечения таких больных. Она позволяет планировать операцию, облегчает выбор позиционирования винтов, избегая их интерференции. Конструктивные особенности имплантата в виде трех жестких фланцев с отверстиями под винты обеспечивают дополнительные участки контакта с интактными частями седалищной, подвздошной и лонной костей, а за счет фиксации винтами достигается первоначальная жесткая стабильность до достижения биологической фиксации.